Leucemia Viral Felina (FELV)
Introducción
El virus de la leucemia felina (FeLV) es tecnicamente un gammaretrovirus que afecta a felinos domésticos de todo el mundo, y esporádicamente a felinos salvajes. La forma más común de contagio es una transmisión horizontal, siendo las más frecuentes por contacto con saliva y por el consumo de leche de una hembra infectada que esté en una fase virémica.
Etiología
El virus de la leucemia felina pertenece a los retrovirus mamífero tipo C, de la familia Retroviridae, de la subfamilia Orthoretrovirinae y del género Gammaretrovirus. El FeLV está compuesto por un genoma de ARN de cadena simple que, en la célula blanco, se une a través de una fusión de la envoltura viral con la membrana celular y libera la nucleocápside con ARN viral al citoplasma, el cual se transcribe mediante la enzima transcriptasa reversa (RT) a ADN, que es transportado al núcleo celular donde se integra posteriormente al genoma celular denominándose “provirus”. Durante la mitosis celular, las células hijas heredan el provirus generando que el gato pueda permanecer infectado durante toda la vida (Dunham & Graham, 2008).
La infección de FeLV comienza con:
Adsorción vírica a la superficie de la célula blanco.
Fusión de la envuelta vírica con la pared celular y liberación del núcleo cápside con ARN vírico.
El ARN vírico se transcribe a ADN por acción de la transcriptasa inversa. El ADN vírico es transportado al núcleo celular donde se integra. Se forma así el provirus.
Durante la mitosis celular, las células hijas heredan el provirus (ADN vírico integrado). Por ello las infecciones por retrovirus son de por vida.
Producción de nuevas partículas víricas: El ADN integrado, produce ARNm, proteínas de la cápside (gag y pol) y ARN de nuevas partículas. El virión se ensambla bajo la membrana celular donde se encuentran proteínas de la envuelta necesarias para su salida de la célula por gemación. Este proceso no conlleva muerte celular. En ausencia de estímulos o con un nivel inmunológico adecuado, los genes virales se mantienen latentes en la célula huésped por períodos indefinidos (Palmero & Carballés, 2010).
Este virus posee una estructura simple dividida en tres partes. La más interna es la nucleocapside que protege el material genético, la intermedia con diferentes antígenos y la más externa que juega un papel esencial en los mecanismos de reconocimiento molecular y es la que permite la infección de células blanco específicas. Algunas de las proteínas virales, como la p27, se producen en exceso al multiplicarse el virus. Es soluble y se detecta en el ambiente extracelular (sangre y fluidos orgánicos) y en células (neutrófilos y trombocitos), la cual se utiliza para el diagnóstico. Esta proteína también es la responsable de la formación de inmunocomplejos causantes de la glomérulonefritis. Además, se observa la neoformación de antígenos, como el Antígeno de Membrana Celular asociado a Oncornavirus Felino (FOCMA), a quien se le atribuye la formación de tumores. (Lutz & Hosie, 2008).
Clasificación del FeLV
Con base en pruebas de interferencia, neutralización viral y capacidad para replicarse en tejidos no felinos, el FeLV ha sido clasificado en tres subgrupos principales: A, B, C; y un cuarto grupo recientemente asociado a los linfocitos T; de todos los subgrupos mencionados, el FeLV subgrupo A (FeLV-A) es el único contagioso gato-gato en estado natural (Willett & Hosie, 2013).
Al igual que la mayoría de especies de vertebrados, los felinos tienen en su genoma algunos elementos virales endógenos conocidos como “retrovirus endógenos”, los cuales son fragmentos de retrovirus ancestrales que se han integrado y han permanecido en su especie huésped durante millones de años sin producir partículas virales infecciosas (Anai et al., 2012). El FeLV-B es generado a partir de la recombinación entre un virus exógeno (FeLV-A) y los transcriptos de los retrovirus endógenos felinos (Anai et al., 2012), lográndose por tanto, la generación del subgrupo B solo en coinfección con el FeLV-A y encontrándose éste en al menos el 50% de los gatos que padecen linfoma. Es válido resaltar que este proceso de recombinación ha sido comprobado tanto in vivo como in vitro en modelos experimentales (Stewart et al., 2013) y que recientemente, se ha descrito la presencia de secuencias génicas de retrovirus endógenos felinos en el genoma de gatos domésticos, sin encontrarse evidencia de los mismos en otras especies relacionadas del género Felis (Stewart et al., 2011).
El FeLV-C es muy poco frecuente y se considera una mutación del subgrupo A. El mecanismo exacto por el cual son generados estos virus FeLV-C no está completamente esclarecido a la fecha; sin embargo, recientes hallazgos sugieren que el FeLV-A puede sufrir mutaciones puntuales en la glicoproteína de envoltura, la cual le permite unirse a su célula huésped; dichas mutaciones pueden estar favoreciendo una mayor replicación viral in vivo y la posterior conversión a FeLV-C (Stewart et al., 2012). El subgrupo más recientemente descrito es el subgrupo de FeLV-T, el cual recibe su nombre dado su exclusivo tropismo por los linfocitos T, sobre los cuales provoca un fuerte efecto citopático (los demás subgrupos no son citopáticos y salen de la célula mediante gemación (Anderson et al., 2000); este FeLV-T, también es una variante del FeLV-A, en el cual se han fijado mutaciones en gen que codifica la proteína de envoltura, responsables de alta citopatogenicidad de los virus de este subgrupo T. Para su replicación efectiva, el FeLV-T requiere de la presencia de dos proteínas específicas del huésped en los linfocitos T ( Nakaya et al., 2010).
Epidemiología
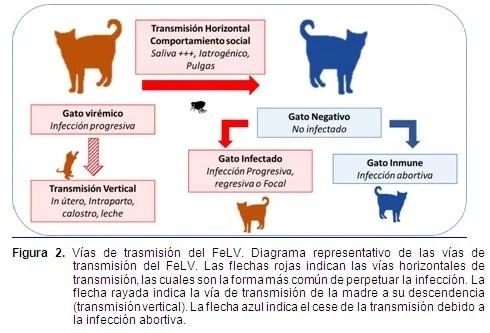
Este virus no tiene predilección por raza ni sexo, aunque se observa una mayor presentación en machos, por sus hábitos callejeros. Se presenta a cualquier edad, aunque es más frecuente en gatos jóvenes de 1 a 3 años. Se describe una resistencia natural a la infección con este virus en los gatos adultos. La transmisión del virus es de forma horizontal, generalmente por inhalación o ingestión. La transmite el felino principalmente por la saliva, ya que se concentra en esta glándula. También elimina el virus por orina y heces, pero en baja concentración. Requiere de un contacto íntimo y prolongado para tener una transmisión efectiva, ya que el virus es lábil en el medio ambiente y se destruye fácilmente por los desinfectantes comunes. Se grafica que este virus es de los “gatos amistosos”. La transmisión transplacentaria y por ingestión de calostro es poco frecuente, pero ésta sucede cuando la madre está en su fase virémica, produciéndose aborto, reabsorción fetal o nacimiento de un gatito infectado congénitamente y con el riesgo de desarrollar una enfermedad tumoral a edad temprana. La incidencia de este virus en EE.UU., es de 1- 8% en gatos. Con pruebas de ELISA, en Santiago de Chile se detectó el antígeno p27 en un 30% en gatos enfermos y en un 20% en gatos clínicamente sanos.
Patogenia
El virus inhalado o ingerido se replica en forma primaria en el tejido linfoide orofaríngeo, seguido rápidamente por una leucocitosis mononuclear transitoria asociado a viremia, con lo cual se distribuye el virus a tejidos linfoides sistémicos donde sufre su segunda réplica, diseminándose luego a médula ósea y a las criptas intestinales. Finalmente infecta los neutrófilos y plaquetas que salen de médula ósea, produciéndose una segunda viremia, infectando así el epitelio de las mucosas y glándulas salivales, para luego excretarse.
Después de la primera réplica si el individuo tiene una respuesta inmune eficaz queda negativo al virus; sin embargo a la segunda réplica si responde adecuadamente el sistema inmunológico, el virus queda latente en médula ósea y por alguna situación de estrés, aplicación de glucocorticoides o por inmunosupresión, puede sufrir una viremia pasajera ó persistente quedando el animal como portador sano. A las seis semanas posteriores a la infección se puede establecer una de las tres posibles relaciones huésped-virus:
Infección activa persistente: Representa el 30% de los casos y cuya infección crónica los predispone a cuadros patológicos en un lapso de 3 a 36 meses. El suero de estos individuos carece de anticuerpos neutralizantes y anti-FOCMA. La inmunosupresión es la forma más frecuente de la viremia, ya que el virus afecta primariamente a las células T, más exactamente a las células T citotóxicas (CD4+) y las T helper (CD8+).
Infección autolimitante: La desarrolla el 40% de los gatos expuestos al virus y terminan siendo inmunes. No presentan viremia, elaboran anticuerpos neutralizantes y anti-FOCMA. Pueden presentar una infección localizada.
Viremia transitoria: La presentan el 30% de los casos, no genera enfermedad aguda, pero tampoco hay una recuperación total, ya que pueden ser reactivados al sufrir una situación de estrés.
Manifestaciones clínicas
Se dividen en dos grandes grupos, las neoplásicas y las no neoplásicas. Siendo las no neoplásicas las más frecuentes (70%). Dentro de las neoplásicas (30%), los linfomas son los más frecuentes (90%).
Enfermedades neoplásicas
Se dividen en neoplasias linfoides (linfoma y leucemia linfoblástica) y neoplasias mieloproliferativas cuyo nombre va a depender del tipo de célula que origina la neoplasia.
Linfoma: Es el tumor más frecuente. Es un tumor maligno compuesto por linfocitos anormales en varias etapas de maduración. En gatos en general son linfoblásticos, pero se pueden mezclar con linfocíticos.
El linfoma felino se clasifica por el sitio primario de la lesión. La forma más frecuente es el mediastínico, el cual llega al área del timo, crece con rapidez y a veces causa derrame pleural. La evaluación citológica, mediante obtención de muestra por toracocentesis, confirma el diagnóstico.
Los signos más frecuentes son la disnea inspiratoria paradojal o asincrónica, disfagia por compresión esofágica o el síndrome de Horner (por compresión de los nervios simpáticos).
Le sigue en frecuencia el linfoma multicéntrico donde se comprometen primariamente los linfonódulos periféricos, el hígado y bazo, dependiendo la signología del compromiso orgánico.
El linfoma alimentario se describe como frecuente en Europa y en gatos viejos, mayores de 8 años; los signos son vómitos y diarreas según su ubicación, pero generalmente este tipo de linfoma es negativo a este virus.
También se describen los linfomas misceláneos, es decir que ocurren en órganos no linfáticos como riñones, cavidad nasal, piel, hígado, vejiga, cerebro y pulmones. El linfoma renal es bilateral y se palpan los riñones aumentados de volumen e irregulares y no causan problemas hasta estar más del 70% de ellos comprometidos.
El diagnóstico se realiza por biopsia de los nódulos linfáticos o de las masas tumorales y también por el análisis citológico del líquido torácico, observándose linfocitos neoplásicos. Al hemograma se puede encontrar una anemia normocítica normocrómica sin respuesta y rara vez se observa linfocitosis o linfocitos anormales en sangre.
Leucemia linfoblástica: La forma aguda es la de mayor prevalencia. Se diagnostica con hemogramas y aspiración de médula ósea, en donde se ve la infiltración por linfoblastos, resultando positivo cuando hay más de 50.000 cel/μl. Las células malignas pueden o no aparecer en sangre.
Los signos son inespecíficos como disminución de peso, anorexia; encontrándose al hemograma anemia no regenerativa, granulocitopenia e inmunosupresión.
Neoplasias mieloproliferativas: Pueden derivar de los eritrocitos, megacariocitos, granulocitos y monocitos. Éstas pueden ser agudas o crónicas. Las agudas se caracterizan por el predominio de células muy indiferenciadas y/o blastos (eritroblastos, mieloblastos, monoblastos, etc.) en sangre y tejidos hemopoyéticos, con un curso clínico corto y con una menor respuesta a los tratamientos quimioterápicos. El diagnóstico se realiza cuando en médula ósea el componente eritroide es menor del 50% y más del 30% de las células blastos son identificadas como mieloblastos y monoblastos. Las crónicas se caracterizan por la proliferación y predominio de células maduras en sangre y médula ósea, con un curso clínico más prolongado que la forma aguda.
Estas leucemias se clasifican en subgrupos, de acuerdo al criterio FAB humano, designándola con el nombre de la célula neoplásica que está involucrada y además con la sigla M seguida de un número que va de 0 a 7, de acuerdo a la etapa de diferenciación de la célula neoplásica predominante, Por ejemplo: la leucemia indiferenciada se denomina M0, la leucemia mieloblástica M1, la promielocítica M3, etc. Para poder clasificar dichas neoplasias es necesario realizar tinciones citoquímicas tanto de los hemogramas como de los mielogramas y para ello existen varias reacciones citoquímicas que permiten en menor o mayor grado la identificación de diferentes tipos de blastos. Las más comunes son las tinciones de PAS (ácido peryódico de Schiff); las mieloperoxidasas; Sudán negro B y dentro de las más específicas se utilizan las estearasas específicas (cloroacetato naftol AS-D) y no específicas (acetato alfa- naftil); la fosfatasa alcalina y ácida.
Enfermedades no neoplásicas
Anemia no regenerativa: A veces se acompaña de leucopenia y trombocitopenia. El 75% de los felinos con anemia tienen el virus VILEF. Un porcentaje pequeño de estas anemias son hemolíticas regenerativas, y se asocian a inmunosupresión provocada por la infección del subgrupo A, facilitando la infección por Haemobartonella felis. Además este virus provoca alteración de la membrana celular de los glóbulos rojos provocando hemólisis.
Las anemias normocíticas normocrómicas no regenerativas ocurren secundarias a enfermedades mieloproliferativas (subgrupo B), a fibrosis medular o osteoesclerosis.
La anemia aplásica es la más frecuente y se asocia al subgrupo C. Generalmente esta ocurre en gatos jóvenes entre los 2 a 3 años de edad y se caracteriza por destrucción de los precursores eritroides.
Trombocitopenia: Hay disminución en la producción de plaquetas por supresión medular o por invasión de células leucémicas. La vida de las plaquetas se acorta y su tamaño aumenta.
Anormalidades leucocitarias: Disminuyen los granulocitos y linfocitos, sobre todo en los recientemente infectados. Los gatos con granulocitopenia presentan persistencia de enfermedades bacterianas. Se observa el síndrome “panleucopenia like” el cual es similar a la panleucopenia viral felina. Consiste en leucopenia y enteritis hemorrágica, teniendo también anemia y trombocitopenia; diferenciándose de la panleucopenia viral por la cronicidad y porque el tejido linfoide intestinal está normal o hiperplásico.
Inmunosupresión: Hay una alteración en la respuesta de anticuerpos humorales debido principalmente a la disminución de las funciones de las células T auxiliares, al mismo tiempo se observa un aumento no específico de Ig G e Ig M. Además de la granulocitopenia se aprecia una menor actividad quimiotáctica y fagocítica de éstos. Las infecciones a las cuales están expuestos estos animales son las bacterianas (estomatitis, abscesos, piotórax, dermatitis, etc.); mycoplasmas (haemobartonellosis); virales (PPIF, infecciones de vías respiratorias altas, etc.); protozoaria (toxoplasmosis) y micóticas (aspergilosis y criptococosis).
Trastornos reproductivos: Un 60 a 70 % de las infertilidades son por causa del VILEF. El aborto es más frecuente en el segundo trimestre de la preñez.
Síndrome del gato débil: Los gatitos nacidos de una hembra infectada se exponen al virus en forma trasplacentaria, pero con mayor riesgo de infectarse al nacer y durante la lactancia. Presentan letargo, caquexia, poco pelaje y/o muerte en las primeras semanas de vida. A la necropsia presentan atrofia tímica.
Glomérulonefritis: El 70% de los gatos que tienen esta alteración son positivos al VILEF. El mecanismo de producción de ésta se asocia al antígeno p27.
Poliartritis: Causada por complejos inmunes, produciendo en el gato joven una artritis fibrosa anquilosante y en el gato viejo una sinovitis linfocítica plasmocítica.
Osteocondromatosis: Se ven comprometidos los huesos planos después de cerradas las fisis, por lo tanto es una patología de animal adulto.
Linfoadenopatías: No siendo neoplásica sino una hiperplasia ganglionar como respuesta a la infección persistente del VILEF. A veces se resuelve a los 30 días, pero tiene riesgo de transformarse en tumor. (Wolf, 2003).
Diagnóstico
La infección persistente por FeLV se traduce en la presencia continua del virus en la sangre, de antígenos virales solubles y de glóbulos blancos que contienen antígenos del virus. Las proteínas del FeLV son muy inmunogénicas (capaces de inducir una respuesta inmunitaria específica) y antigénicamente idénticas para todos los subgrupos de FeLV. La proteína de la cápside viral p27 se sintetiza en gran cantidad y se encuentra tanto en el citoplasma celular como en el medio extracelular como antígeno libre (Sand et al., 2010); existen diferentes pruebas analíticas que pueden detectarla, algunos como los test rápidos diseñados para realizarlos en las clínicas veterinarias (ELISA e inmunocromatografía), y otras que deben ser realizadas en laboratorios de análisis especializado (inmunofluorescencia). Desde finales de los años ochenta, el diagnóstico serológico de animales seropositivos se basa en el uso de pruebas de detección de antígeno (p27), por lo que a diferencia de otras infecciones de importancia en felinos, la detección de anticuerpos no tiene generalmente valor clínico y en la actualidad no es tenida en cuenta para la caracterización de los estadios clínico.
Como si lo es la presencia del antígeno ( Hartmann et al., 2007). ELISA: detecta el antígeno viral extracelular libre en plasma (proteína p27). Tiene alta sensibilidad (90%) y alta especificidad, excepto en lágrimas y saliva, estas dos no deben utilizarse para esta prueba, ya que la liberación viral en estos fluidos es intermitente; la muestra ideal es plasma o suero, los cuales se han demostrado que funcionan mejor que el uso de sangre entera. Como esta prueba detecta los antígenos virales y no la presencia de anticuerpos, no se ve afectada por la presencia de anticuerpos maternales en calostro o por los anticuerpos generados por la vacunación (Dunham & Graham, 2008). Inmunofluorescencia directa (IFD): detecta el antígeno viral p27 intracelular en el citoplasma de neutrófilos, plaquetas y médula ósea. A causa de la infección de la médula ósea, los neutrófilos y las plaquetas salen a torrente sanguíneo infectados por el FeLV, por lo que estas células solo arrojan resultados positivos aproximadamente tres semanas después de la exposición. La IFD fue el primer método desarrollado para el diagnóstico de rutina del FeLV; sin embargo, como requiere equipos especializados, ahora es usada solo para evaluar el pronóstico del paciente o para confirmar muestras positivas o sospechosas. Puede presentar falsos positivos cuando hay trombocitopenia o neutropenia; cuando los frotis de sangre son muy gruesos, cuando la prueba es preparada o interpretada por alguien sin experiencia (Hardy et al., 1973). Reacción en cadena de la polimerasa –PCR/RT-PCR: detecta secuencias de ácido nucleico viral (ADN proviral o ARN viral). Es una prueba altamente específica para diferencias desde el subtipo hasta la cepa; sin embargo requiere buenas condiciones de laboratorio y personal calificado, pues a la menor alteración del manejo de muestras pueden destruir el delicado ácido nucleico o introducir cantidades mínimas de contaminación cruzada, llevando a falsos positivos o a falsos negativos. La mayoría de las pruebas de PCR detectan ADN proviral (secuencia de genoma viral integrado en el genoma del huésped), siendo por tanto, de gran utilidad para la confirmación de infecciones regresivas o focales en las cuales no hay replicación viral o es mínima y las pruebas que detectan antígenos darían resultados negativos (Cattori & Hofmann-Lehmann, 2008; Stützer et al., 2011). Por su parte, la RT-PCR permite la detección directa del ARN viral libre, pudiéndose realizar a partir de muestras de sangre entera, suero, plasma, saliva y heces. Un resultado positivo a esta última es un indicador de viremia al detectar ARN viral. Es de utilidad en colonias para detectar positivos en gatos poco manejables utilizando saliva, ya que es muy sensible; y realizándola de forma cuantitativa (qRT/PCR), permite evaluar la carga viral del paciente, lo cual es de gran utilidad en el manejo y pronóstico terapéutico cuando se usan antirretrovirales (Cattori et al., 2008). Inmunocromatografía o pruebas rápidas: hoy en día se hace uso de técnicas rápidas basadas en un principio similar al ELISA, los ensayos inmunocromatográficos, en los cuales se genera una banda o un spot de color como resultado de una reacción inmunológica demostrando la presencia del antígeno viral p27. Son comercialmente conocidos como “SNAPs” (nombre dado por la casa comercial IDEXX® quien los licenció inicialmente) y son los más utilizados por su fácil manejo, su rápido resultado y su alta sensibilidad; además, entre sus ventajas se incluye el hecho que la prueba cuenta con controles positivos y que pueden simultáneamente detectar varios patógenos de importancia en medicina veterinaria, tanto virales, como el caso del virus del sida felino (FIV), o parasitarios. Distintos trabajos de investigación han demostrado la gran utilidad de estas pruebas rápidas pues logran una baja o casi nula tasa de falsos positivos o falsos negativos, con la gran ventaja que su realización no requiere ningún tratamiento previo de la muestra del paciente (sangre o suero), lo que los ha posicionado como la mejor alternativa para el diagnóstico del FeLV en los hospitales y clínicas veterinarias del mundo ( Sand et al., 2010).
Profilaxis
Existen varias vacunas en el mercado internacional, unas con sólo el subtipo A, otras contienen los tres subtipos más el antígeno FOCMA, otras tienen por ingeniería genética sólo los antígenos inmunizantes, etc. (Muñoz, 2001).
Lo importante en las vacunas es que contenga el subtipo A, que es el transmisible. En general, el rango de protección de las vacunas va desde el 70 al 85% de protección.
A partir del 2001 la AAFP (American Association Feline Practioners), recomienda colocar las vacunas contra leucemia vía subcutánea en el miembro posterior izquierdo, a las 8 semanas de edad y repetir a las 12 semanas y hacer un refuerzo una vez al año. Alrededor de 1996 se recomendaba colocar esta vacuna en la base de la cola. La tendencia en Europa es colocar las vacunas en diferentes partes del cuerpo e ir marcando el sitio de inoculación en un esquema de gato impreso en la ficha clínica, para evitar inoculaciones en el mismo sitio. Todas estas medidas son para evitar la presentación del fibrosarcoma y si aparece saber cuál vacuna lo generó y además poder amputar el miembro en caso de que esta neoplasia esté avanzada.
Se debe realizar la prueba de ELISA antes de vacunar al paciente y sólo vacunar a los gatos negativos. En caso de salir el examen positivo sin estar enfermo, se recomienda repetir la prueba alrededor de 1 a 3 meses después (Muñoz, 2001).
Se ha visto la aparición de fibrosarcomas en el lugar de la inoculación de la vacuna, con una incidencia de 1:10.000; por lo tanto se recomienda vacunar sólo a los gatos de alto riesgo de contraer la enfermedad, es decir gatos machos enteros, que salgan a vagabundear, o gatos que viven hacinados, pero no vacunar a los gatos de departamento ni a los que no tienen contacto con otros gatos. Se debe biopsiar toda pápula que aparece en el sitio de vacunación después de 3 meses de realizada o bien cuando mide 2 cm de diámetro, para diagnosticar en forma temprana el fibrosarcoma. Otras formas de prevenir esta enfermedad es realizando la orquiectomía u ovariohisterectomía a los gatos a edad temprana para evitar el vagabundeo, mantener una adecuada higiene en el hogar, lavando los platos de comida periódicamente y retirando diariamente las heces de los baños sanitarios (Muñoz, 2001).
Al introducir un gato nuevo éste debe ser negativo a la prueba de ELISA, siendo lo ideal dos pruebas con resultado negativo en un lapso de un mes, al igual que los animales de criaderos que están en servicio.
Un gato positivo asintomático se debe mantener desparasitado, vacunado contra la panleucopenia, los virus respiratorios y la antirrábica, sobre todo si es de exterior, usando las vacunas a virus vivo modificado, porque contienen menos adyuvante que las vacunas a virus muerto y así disminuye la posibilidad de generar fibrosarcomas. No se recomienda vacunarlos contra la leucemia. Se debe realizar la orquidectomía u ovariohisterectomía para evitar que estén en contacto con otros gatos y contraigan otro tipo de enfermedades, evitando además el estrés de los celos. Si este gato convive con más gatos y éstos son negativos, se deben mantener separados y si no se puede, estos últimos deben vacunarse contra la leucemia (Muñoz, 2001).
Bibliografía
ANAI, Y; OCHI, H; WATANABE, S. 2012. Infectious endogenous retroviruses in cats and emergence of recombinant viruses. Journal of virology. Pp 834 – 844.
ANDERSON, M; LAURING, A; BURNS, C. 2000. Identifications of a cellular cofactor required for infections by feline leukemia virus. Science. Pp 1828-1830.
CATTORI, V; TANDON, R.2008. Investigation of feline leukemia virus proviral and viral RNA loads in leucocyte subsets. Veterinary immunology and immunopathology. Pp 124 – 128.
DUNHAM, S; GRAHAM, E. 2008. Retroviral infections of small animals. Veterinary clinics small animal pactice. Pp 879 – 901.
HARMANN, K; GRIESSMARYR, P; SCHULZ, B. 2007.Qualityof different in clinic test systems for feline immunodeficiency virus and feline leukemia virusinfections. Journal of feline medicine and surgery. Pp 439 – 445.
HARDY, W; HIRSHAUT, Y; HESS, P.1973. Detection of the feline leukemia virus and other mammalian onornaviruses by immunofluorescense. Pp 778 – 799.
LUTZ, H; HOSIE, M. 2008. Feline retrovirus infections: Felv / Fiv. Feline congress. Edinburgh. Pp 25 – 28.
MUÑOZ, L. 2001. Enfermedades virales felinas. Parte II, Tecnovet. 7 (2).
KAYA, Y; SHOJIMA, T; HOSHINO, S. 2010. Focus assay on FeLIX – dependent feline leucemia virus. Journal veterinary medical science. Pp 117 -121.
PALMERO, M; CARBALLÉS, V. 2010. Leucemia Felina. Enfermedades infecciosas felinas. Pp 5 – 99.
SAND, C; ENGLERT, T; EGBERINK, H. 2010. Evaluation of a new in clinic test system to detect feline immunodeficiency virus and feline leukemia virus infection. Veterinary clinical pathology. Pp 210.
STEWART, H; JARRETT, O; HOSIE, M. 2011. Are endogenous feline leukemia viruses really endogenous? Veterinay immunology and inmunopathology. Pp 325 – 331.
STEWART, H; ADEMA, K; MCMONAGLE, 2012. E. Identification of novel subgroup A variants with enhanced receptor binding and replicative capacity in primary isolates of anaemogenic strains of feline leukaemia virus. Retrovirology.
STEWART, H; JARRETT, O; HOSIE, M. 2013. Complete genome sequences of two feline leukemia virus subgroup B isolates with novel recombination sites. Genome announcements.
STÜTZER, B; SIMON, K. 2011. Incidencia of persistent viremia and latent feline leukemia virus infection in cats with lymphoma. Journal of feline medicine and surgery.Pp 81- 87.
WILLET, B; HOSIE, M: 2013. Feline leuckemia virus: half a century since its discovery. The Veterinary Journal. Pp 16 – 23.
WOLF, A. 2003. Care of the FELV/FIV infected cat, proceedings the north American conference