Ácido Base
Gasometría arterial y equilibrio ácido base
Las alteraciones del equilibrio ácido-base deben sospecharse en los pacientes críticos, con signos vitales anormales y alteraciones de conciencia; generalmente asociados a vómitos, diarrea o cambios en el flujo urinario. Esta situación puede comprometer la supervivencia en algún momento de su evolución, por lo que la muerte es una alternativa posible.
El equilibrio ácido base regula las concentraciones de de los iones H+ en los líquidos corporales. Pequeños cambios en la [H+] pueden producir grande alteraciones bioquímicas en las células, siendo la regulación ácido-base uno de los aspectos más importantes en la homeostasis. El pH sanguíneo arterial se mantiene normalmente entre 7,35-7,45 y cualquier desviación de este rango provoca desequilibrios clínicamente importantes. Esta es una situación de equilibrio establecido en el balance entre sustancias de carácter ácido y básico de la sangre, como consecuencia de la interacción entre los sistemas respiratorios y metabólicos. El hígado metaboliza las proteínas produciendo los iones hidrógeno H+, el pulmón elimina el dióxido de carbono CO2 y el riñón genera bicarbonato HCO3-.
La respiración regula indirectamente la concentración de ácido del organismo, manteniendo la presión parcial de dióxido de carbono pCO2 en sangre arterial (compensación respiratoria). La respuesta ventilatoria ante los cambios de pH es una respuesta rápida y está mediada por los quimiorreceptores de los corpúsculos carotideos y aórticos y del centro respiratorio bulbar.
El riñón es un órgano clave implicado en la regulación del equilibrio ácido-base, porque es la principal vía de eliminación de la carga ácida metabólica normal y de los metabolitos ácidos patológicos. Es el órgano responsable de mantener la concentración plasmática de bicarbonato en un valor constante. En una situación de acidosis se producirá un aumento en la excreción de ácidos y se reabsorberá más bicarbonato, mientras que en una situación de alcalosis ocurrirá lo contrario, es decir, se retendrá más ácido y se eliminará más bicarbonato.
pH: El valor de pH equivale a la concentración de hidrogeniones [H+] existente en sangre. Expresa numéricamente el mayor o menor grado de acidez Es el logaritmo negativo de la concentración del ion hidrógeno. El logaritmo debe ser definido como de base 10 y la concentración debe ser medida como la actividad en moles por litro.
PO2: El valor de presión parcial de O2 en sangre y corresponde a la presión ejercida por el O2 que está disuelto en el plasma. No debe confundirse con la cantidad que se encuentra unida a la hemoglobina en una combinación química reversible, o a la cantidad total existente o contenido de oxígeno. Suele expresarse en mm Hg o unidades Torr. En el individuo sano su valor respirando aire ambiente y a nivel del mar, siempre debe ser superior a 80 mmHg.
Sat O2: El valor de saturación de oxihemoglobina sO2% corresponde al porcentaje de hemoglobina que se halla unida reversiblemente al O2. Respirando aire ambiente y a nivel del mar, en un individuo sano debe ser superior al 90%. La observación clínica de que la sangre arterial y venosa tiene un color diferente constituye la base para la medición espectrofotométrica de la sO2%.
PCO2: La presión parcial de CO2 corresponde a la presión ejercida por el CO2 libre en plasma. Es el componente respiratorio del estado ácido-base. Se expresa en las mismas unidades que la pO2 (mmHg, Torr o kPa). En el individuo sano su valor oscila entre 35 y 45 mmHg. A diferencia de la PO2, no varía con la edad.
CO2 total en el plasma: Es la suma de todas las formas de CO2 disuelto; ácido carbónico, bicarbonato, compuestos carbamino. Equivale en la práctica al valor del bicarbonato real mas 1-2 mmoles/l (VN 26-28 mmoles/L plasma).
Bicarbonato: Base débil con capacidad captar de manera reversible iones H+ del medio, y actuar como tampón o regulador del pH. En las determinaciones ácido-base la concentración de ion bicarbonato HCO3-, se expresa en miliequivalentes por litro, se calcula a partir de la PCO2 y del pH.
Exceso de Bases: Es una medida del nivel de ácido metabólico, y normalmente es cero. Los cambios se expresan en términos de exceso o déficit. El exceso de base puede utilizarse para estimar la cantidad de tratamiento necesario para neutralizar la acidosis metabólica (o alcalosis).
Anión gap: Para mantener la electroneutralidad, las cargas positivas (cationes) deben igualar a las cargas negativas (aniones); si no ocurre así, aparece un anión gap, cuyo valor normal es de 8 a 16 mEq/L y que se calcula con la siguiente ecuación: Na – (Cl- + HCO3- ).
Interpretación clínica de los análisis ácido-base
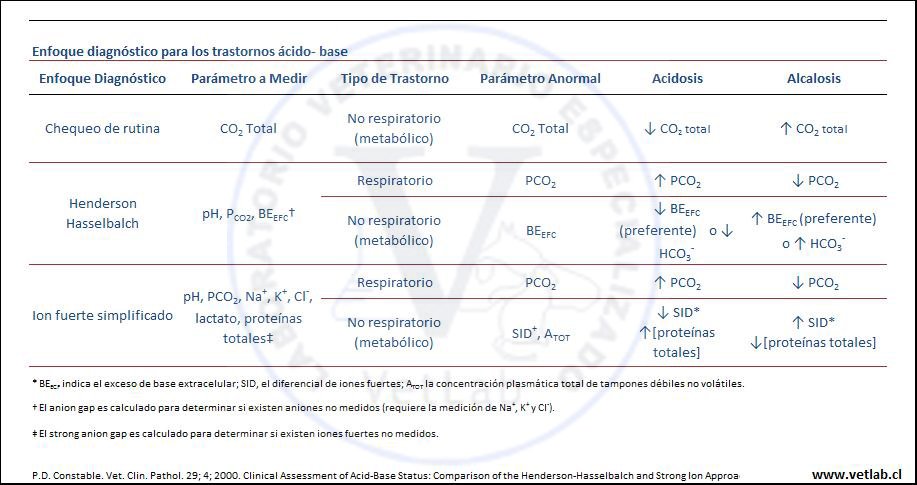
El enfoque tradicional para evaluar clínicamente el estado ácido-base se ha sustentado en la ecuación de Henderson-Hasselbalch, categorizando las 4 principales alteraciones ácido-base: acidosis respiratoria (aumento de la PCO2), alcalosis respiratoria (disminución de la presión de dióxido de carbono PCO2), acidosis metabólica (disminución del exceso de base extracelular BEEFC o de la concentración del bicarbonato actual [HCO3-]act) y alcalosis metabólica (aumento del BEEFC o de la concentración del [HCO3-]act). (Tabla 5) El anión gap (AG) es también un parámetro relevante y se obtiene mediante la determinación de los aniones no identificados previamente en el plasma. Este enfoque funciona bien clínicamente y se recomienda su uso si las concentraciones de proteínas plasmáticas y fosfato son normales. Sin embargo, cuando estas concentraciones son marcadamente anormales, la utilización de este modelo puede ser imprecisa. Otro nuevo enfoque cuantitativo (Singer, Hastings, Stewart) para la evaluación físico-química equilibrio ácido-base, utiliza un modelo basado en la presencia de iones fuertes para categorizar las principales alteraciones ácido-base.
El enfoque tradicional es dependiente de los niveles plasmáticos de PCO2, de la concentración de bicarbonato [HCO3-], del logaritmo negativo de la constante de disociación (pK1´) para el ácido carbónico (H2CO3) y de la solubilidad del dióxido de carbono (SCO2). Todos estos factores interactúan para determinar el pH sanguíneo, y su relación se expresa en la ecuación de Henderson-Hasselbalch:
pH = pK1´ + Log ([HCO3-] / SPCO2)
La evaluación del equilibrio ácido-base por este modelo ha utilizado históricamente el pH como un parámetro global del equilibrio ácido-base; la PCO2 como una medida dependiente del componente respiratorio; el EBEFC, la concentración de [HCO3-]act y el [HCO3-]std como parámetros del componente no respiratorio (también llamado metabólico).
Con este enfoque se definen 4 alteraciones ácido-base de relevancia: acidosis respiratoria (aumento de la PCO2), alcalosis respiratoria (disminución de la PCO2), acidosis metabólica (disminución del BEEFC, de la concentración de [HCO3-]act, o del [HCO3]std y alcalosis metabólica (aumento BEEFC), de la concentración de [HCO3-]act o del [HCO3]std. El AG se calcula para incorporar los aniones no medidos en el modelo.
Exceso de Base. La capacidad del BEECF y de la concentración de [HCO3-]act para caracterizar con precisión el componente metabólico del equilibrio ácido-base, ha sido motivo de controversia. Cuando se evalúa el componente metabólico del equilibrio ácido-base, BEECF tiene ventajas sobre la concentración de [HCO3-]act. La principal ventaja es que BEECF está relacionado con el diferencial de los iones fuertes, y la principal desventaja de la concentración de [HCO3-]act es que no es independiente de la actividad respiratoria.
Por definición, el valor normal del BEECF para humanos es 0 mEq/L (rango -2 a 2 mEq/L). Un BEECF > 2 mEq/L indica alcalosis metabólica, mientras que un valor < -2 mEq/L refleja una acidosis metabólica. Aunque el BEECF ha sido ampliamente aplicado en los trastornos ácido-base en los animales domésticos, los valores calculados no son completamente válidos en al menos 4 especies de animales domésticos: perro, cerdo, vaca y oveja. Este error surge porque el valor normal de BEECF en perros es de -6,6 mEq/L, en ovejas de 2,5 mEq/L), en vacas de 3,4 mEq/L y en cerdos de 6,0 mEq/L, lo cual se contrapone con la definición original de BEECF en cuanto a que su valor normal para todas las especies debería ser 0 mEq/L. Además, el valor de la concentración de hemoglobina y la capacidad de tamponamiento de las proteínas del plasma varían según la especie, como también varía el pH sanguíneo normal y la PCO2. No obstante, manteniendo el supuesto teórico de que existe una relación lineal entre PCO2 y pH sanguíneo, con una pendiente que depende de la capacidad de tamponamiento de la sangre, se utilizan habitualmente en la evaluación clínica acido-base de animales domésticos, los valores de referencia humanos para BEECF, asumiendo un error considerado marginal, aunque existen nomogramas y ecuaciones para el cálculo del BEECF en los distintos animales domésticos.
Concentración de bicarbonato actual [HCO3-]act
El [HCO3-]act no se mide directamente, sino que se calcula mediante la ecuación de Henderson – Hasselbalch, con valores medidos de pH y PCO2. Al ser calculado a partir de estos 2 parámetros, no puede ser una medida independiente del componente no respiratorio de los trastornos ácido – base. Una disminución primaria en la PCO2 (alcalosis respiratoria), con un pH normal, siempre se asocia a una disminución del [HCO3-]act (lo cual puede ser interpretado como una acidosis metabólica). Asimismo, un aumento primario de la PCO2 (acidosis respiratoria), con un pH normal, siempre produce un incremento en la concentración plasmática de [HCO3-]act (lo cual puede ser interpretado como una alcalosis metabólica). En ambos casos, la concentración plasmática de [HCO3-]act dependerá del pH y la PCO2 y no proporciona información adicional acerca de la causa del trastorno ácido – base definido previamente por el pH y la PCO2. Por lo tanto, no es lógico utilizar la concentración de [HCO3-]act para definir el componente no respiratorio (metabólico) de un trastorno ácido – base.
Concentración de bicarbonato actual [HCO3-]std
La concentración plasmática de [HCO3-]std (en meq/L) se define en un volumen de sangre humana a 37°C en una mezcla gaseosa equilibrada con oxigenación normal y una PCO2 de 40 mm Hg. El valor normal del [HCO3-]std plasmático humano es de 24 mEq/L (rango,22-26 mEq/L). Para los seres humanos, un [HCO3-]std 26 mEq/L refleja una alcalosis metabólica. La validez del [HCO3-]std en otras especies no humanas es cuestionable; perros, rumiantes, caballos y cerdos sanos tienen el concentraciones de [HCO3-]std distintas a las de humanos. La concentración de este parámetro se calcula generalmente a partir del valor de BEEFC, lo que indica que proporciona una información similar al exceso de base.
Anion Gap (AG): El concepto AG surge del criterio de electroneutralidad, donde AG representa la diferencia entre la concentración de aniones [UA] y la concentración de cationes [UC] no medidos previamente en la sangre. La concentración sérica de potasio debe ser siempre incluida en el cálculo AG, puesto que en los animales domésticos la potasemia puede variar significativamente. El valor de AG puede ser calculado de acuerdo a la siguiente ecuación:
[UA] – [UC] = ([Na+] + [K+]) – ([Cl-] + [HCO3-]) = AG
La cual indica que un cambio en [UA] o [UC] causará un cambio en la AG. Un aumento de AG, por lo tanto, se refleja un aumento de la UA (lo más probable) o una disminución en la UC (menos probable). Aproximadamente dos tercios de la AG se origina a partir de la carga neta negativa de las proteínas séricas (predominantemente albúmina), mientras que el resto refleja la concentración sérica de fosfato y aniones fuertes, como sulfato, lactato, β- OH-butirato, acetoacetato, y los aniones asociados a la uremia.
El AG puede alterarse por los cambios en las concentraciones de proteínas y fósforo en el suero, y también por los cambios en pH, por lo que debe ajustarse ante los cambios en estos parámetros. Una disminución 1-g/dL en la concentración de proteínas plasmáticas disminuye el valor AG en 3,7 mEq/L, mientras que una disminución de 1g/dL en la concentración plasmática de albúmina disminuye el valor de AG en un 2,5 mEq/L. Sin embargo, el ajuste matemático no necesariamente mejora la utilidad clínica de AG, por lo que no se recomendable en la evaluación de ácido-base de los animales domésticos.
Modelo complementario para la interpretación clínica del equilibrio ácido-base
El modelo de Iones Fuertes de Singer y Hastings propone que el pH plasmático se determina por 2 factores independientes: la PCO2 y la carga neta de iones fuertes, la cual equivale al diferencial de iones fuertes (SID+). Este diseño fue complementado por Stewart, sugiriendo una tercera variable: la concentración plasmática total de tampones débiles no volátiles (ATOT), por ejemplo, albúmina, globulinas y fosfatos, los que también ejercen un efecto independiente sobre el pH plasmático. Una de las principales contribuciones de Stewart a la fisiología clínica ácido-base, fue su propuesta de que el pH sanguíneo se determina por 3 factores independientes: la PCO2, la carga neta de iones fuertes (equivalente a SID+: diferencia de carga entre los cationes y aniones plasmáticos fuertes completamente disociados) y los tampones débiles no volátiles (ATOT).
Manejo de muestras para análisis de pH y gases sanguíneos
Entre la extracción de la muestra sanguínea y su análisis no deben pasar, en condiciones habituales, más de 30 min. En todo momento es imprescindible mantener la muestra hermética. Si se prevé que dicho lapso de tiempo será superior, la muestra arterial o venosa debe guardarse en hielo. Con ello se retarda el metabolismo eritrocitario y se evita la declinación de la PO2 y el incremento de la PCO2 (con la consiguiente tendencia a la acidosis), que se producen con el paso del tiempo en condiciones de temperatura ambiental.